Эпигеном: параллельная реальность внутри клетки
Что представляет собой эпигеном, какова его роль в жизни клетки и чем он выступает по отношению к геному? Второстепенным дополнением, неким приложением или же загадочной, малоизученной системой, управляющей генетическими процессами? В последние годы наука находит всё новые определения этому термину. Предрасположенность к наследственным болезням, генетическая стабильность, адаптация, реакция на стрессовые факторы, темпы развития и старения клеток — во всём этом задействована «структура» под названием эпигеном. Изучение эпигенетических закономерностей открывает для биологии двери в лабиринты познания, где можно найти ответы на многие неразрешимые вопросы современной науки.

Младшая сестра генетики
Чтобы понять, что такое эпигеном и эпигенетика, сначала нужно прояснить, что такое геноми генетика. Геном — это совокупность генов того или иного организма. Генетика — наука, изучающая механизмы реализации генетической информации и передачи генов потомству. Соответственно, эпигеном — совокупность специфических меток, определяющих активность генов, но не затрагивающих первичную структуру ДНК. Эпигеном (приставка «эпи-» в переводе с греческого означает «над») представляет собой своеобразный регуляторный слой, расположенный как бы «над» геномом клетки. Условно говоря, эпигеном раздает команды, какие гены должны работать (экспрессироваться), а какие — отдыхать (или «молчать», то есть находиться в состоянии сайленсинга). Эпигенетика — научное направление, изучающее эпигенетические модификации генома, пути реализации состояний генов, их передачу в клеточных генерациях и механизмы регуляции наследственной информации (без изменения нуклеотидной последовательности) в ответ на действие внешних факторов [1].
Со времени первых открытий в области генетики и до недавних пор в науке прочно укоренилось представление о том, что структура ДНК — это единственный носитель наследственной информации. Благодаря крупномасштабным расшифровкам геномов, в том числе человеческого [2], была раскрыта природа гена и мутаций — нарушений генетической записи, — поняты принципы организации ДНК, изучены последовательности нуклеотидов, обусловливающие наследственные патологии. Было установлено, что генетическая информация человека хранится в 23 парах хромосом, содержащих 20–25 тысяч генов (оказалось, что точно определить их количество тоже не очень-то просто [3]), или три миллиарда пар нуклеотидов, несущих азотистые основания преимущественно четырех типов: аденин, тимин, гуанин, цитозин (сокращенно — А, Т, Г, Ц). Однако роль внешних факторов в механизмах реализации генетической информации была сведена к минимуму. Проще говоря, ученые считали: что записано в генόм, того не вырубишь топором [4].
Действительно, ДНК — это основа основ большинства жизненных форм. В ее структуре записано всё о живом организме, начиная с его видовых характеристик, морфологических параметров, предрасположенностей к болезням, заканчивая типом высшей нервной деятельности, поведенческими особенностями и наклонностями. Но было бы неправильно воспринимать геном как некий фатум, которым заранее предопределена жизнь индивида. Не всем генетическим «предсказаниям» суждено сбыться: некоторые из них еще не раз будут переписаны в течение онтогенеза (индивидуального развития организма).
В ходе долгих поисков биологи сделали ряд интересных наблюдений. К примеру, генетически идентичные лабораторные мыши во время беременности употребляли разный по составу корм. Одни мыши получали пищу, обогащенную биологически активными добавками, в частности фолиевой кислотой — источником метильных групп, а другие ели обедненный корм. Потомство мышей в итоге приобрело морфологические и физиологические различия. Мыши, родившиеся от матерей, употреблявших обогащенный корм, были здоровыми и имели окрас бурого цвета, а мыши, рожденные от матерей, питавшихся неполноценно, были болезненными и имели желтый окрас. Так было установлено, что некачественное питание, образно говоря, «отключило» у потомства некоторые гены, отвечающие как за цвет шерсти, так и за устойчивость иммунитета . Признаки, приобретенные индивидуумами, передавались потомству. При этом сам набор генов (генотип) оставался неизменным, то есть последовательности ДНК не затрагивались [5].
Со временем ученые пришли к выводу, что активность многих генов непостоянна: они включаются (экспрессируются) и выключаются (репрессируются) в зависимости от воздействия внешних факторов. Это изменение активности генов, не затрагивающее первичную структуру ДНК, но влияющее на проявление тех или иных свойств и признаков, и составило предмет изучения эпигенетики.
Эпигенетика — сравнительно молодое направление науки. Впервые этот термин в 1942 году употребил английский ученый Конрад Уоддингтон. Изучая ряд закономерностей, научное сообщество пришло к выводу, что функции живого организма не обусловлены одной только закодированной в генах информацией, а во многом служат ответом на сигналы из окружающей среды. То, как происходит эпигенетически обусловленное включение и выключение определенных генов, стало одним из важных открытий современности, за что в 2006 году американским исследователям присудили Нобелевскую премию [10].
Классическая менделевская генетика опирается на то, что в основе изменений фенотипических признаков лежат мутации ДНК, то есть механические — случайные или индуцированные — изменения структуры наследственной информации. Эпигенетика опирается на варианты нормы, представленные модификациями. Каждое из нарушений эпигенома имеет не меньшее значение, чем генетические нарушения, и выступает эпигенетическим эквивалентом генетической мутации. Однако, несмотря на всю свою значимость, эпигенетика всё равно остается вторичной по отношению к генетике, ее младшей сестрой, ответвлением, а не самостоятельной наукой. Поскольку основным носителем наследственной информации является геном, эпигенетические механизмы могут только управлять работой тех или иных генов, исходя из имеющегося в наличии материала. Эпигеном служит механизмом контроля реализации генетической информации, что осуществляется посредством модификаций отдельных нуклеотидов. Проще говоря, не все гены, которые у нас есть, работают. Одни гены проявляют активность в одной клетке и неактивны в другой, и наоборот. Существуют некие регуляторные элементы, управляющие активностью генов. По современным представлениям, к таким элементам относятся: метилирование ДНК, гистоновые модификации, ацетилирование, фосфорилирование, гликозилирование, разнообразные микроРНК и другие структуры/процессы, «дирижирующие» нашим геномом [10], [11].
Рассмотрим самую известную и самую важную модификацию — метилирование ДНК. Это единственная химическая модификация ДНК, задействованная во многих генетических процессах у эукариот. Метилирование — добавление СН3-группы к цитозину ферментами ДНК-метилтрансферазами (рис. 1), что приводит к инактивации целого гена, в состав которого входит этот модифицированный нуклеотид.
Не пропустите самое важное о науке и здоровье!
Подпишитесь на рассылку и получайте самые важные новости прямо на вашу почту
Опубликовано
Март, 2024
Продолжительность чтения
Около 5-6 минут
Категория
Эпигенетика
Поделиться
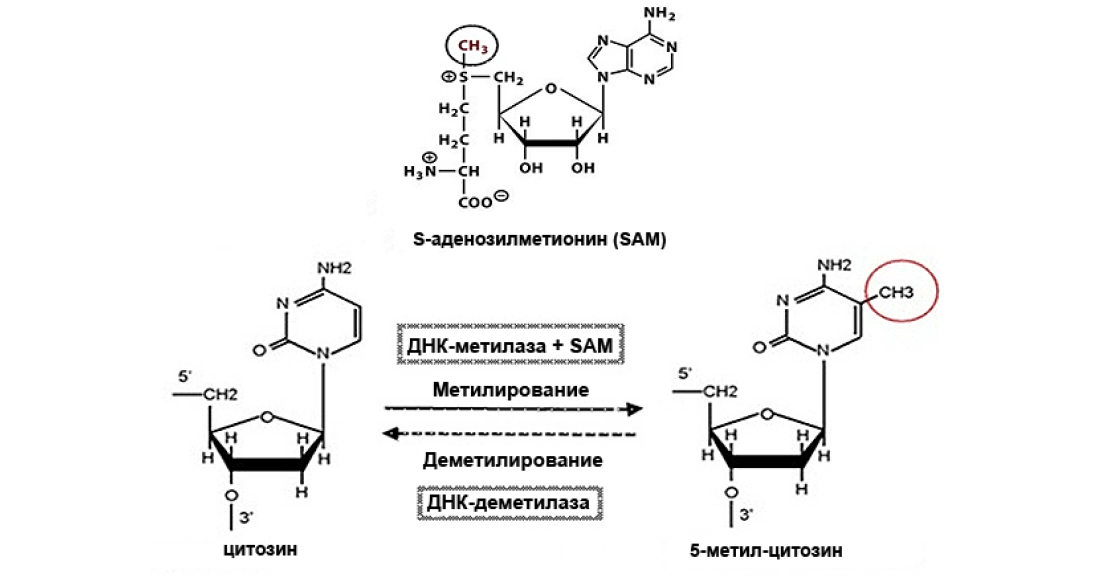
Рисунок 1. Модификация цитозина в 5-метилцитозин с участием ДНК-метилаз и S-аденозилметионина
Что же происходит, когда к цитозину, входящему в состав того или иного гена, присоединяется метильная группа? Оказывается, такая модификация провоцирует присоединение белков, изменяющих состояние хроматина. Чаще всего эпигенетическая регуляция осуществляется именно путем дифференциального метилирования цитозина в специфических участках генома. Формально ген никуда не девается, он продолжает находиться на своем месте, но никак себя не проявляет. Ген словно выключен, он не может производить продукт. В таком выключенном состоянии ген способен наследоваться. Передача потомству признаков, приобретенных организмами в течение жизни, в том числе посредством метилирования, называется эпигенетической наследственностью. Это наследование сохраняется у нескольких клеточных поколений или нескольких поколений живых существ.
Но всегда ли плохо то, что гены выключаются? Если представить, к примеру, что путем такой нехитрой модификации происходит выключение каких-либо вредоносных генов, вызывающих развитие патологий, наследственных аномалий или онкотрансформацию клеток, это же будет хорошо. Однако эпигеном может и навредить организму, инактивируя нужные гены. Еще до конца не изучено, как поддерживаются и воспроизводятся те или иные эпигенетические состояния [1].
Как уже упоминалось, метилирование ДНК влияет на многие генетические процессы у эукариот. Оно контролирует экспрессию генов, задействовано в пререкомбинационных событиях (предшествующих рекомбинации — процессу перераспределения генов между участками хромосом), выполняет функцию защиты от встраивания экзогенных нуклеотидных последовательностей, ограничивает перемещение транспозонов (особых участков ДНК, способных передвигаться по геному). Метилирование связано в основном с репрессией генов, инактивацией чужеродных последовательностей, регулировкой развития и организации генома. Регуляторные эпигенетические механизмы могут вызывать перемены в генетической активности. Метилирование цитозина в ДНК эукариот относится к ключевым факторам их развития. Оно оказывает влияние на структурно-функциональную организацию генома, принимая участие в регуляции конформационных изменений хроматина, что способствует изменениям в соответствующих локусах (местах локализации гена на хромосоме). ДНК в разных типах клеток организма метилирована по-разному. Это связано с расхождениями в выполняемых функциях, степени дифференцировки клеток и свойственной им экспрессии генов [13–15].
Различные эпигеномы как разные варианты реализации наследственной информации представляют собой своего рода набор параллельных реальностей, существующих в каждой клетке нашего организма. От того, какой ген заблокирован или разблокирован, зависит проявление того или иного фенотипического признака, а также скорость старения [16] и способность взаимодействовать с окружающей средой. Является ли это включение-выключение случайным или запрограммированным процессом и как связаны между собой различные «миры» эпигеномов, пока известно мало. Но сам факт того, что наука уже вплотную подошла к таким вопросам, не может оставаться без внимания.
На страже спокойствия генома. Метилирование как защитный механизм
Метилирование как функция защиты генетического материала от встраивания вирусных и других чужеродных нуклеотидных последовательностей встречается даже у таких примитивных живых организмов, как бактерии. Осуществляется это за счет системы рестрикции-модификации. Чужеродная ДНК, попав в бактерию, расщепляется рестриктазами (специальными ферментами, разрезающими ДНК в определенных участках). Однако те же самые последовательности собственной ДНК бактерии защищены от расщепления метильными метками [17].
Считается, что метилирование в качестве механизма, предотвращающего проникновение в геном чужеродных последовательностей, сохраняется и у более сложных организмов. Оно подавляет распространение вирусных генов, тандемных повторов (бессмысленных последовательностей ДНК) и транспозонов. Больше всего таких модификаций наблюдается в некодирующих районах ДНК. Метилирование репрессирует «ненужные» гены путем добавления метильной группы к цитозиновым остаткам в составе этих последовательностей. У млекопитающих, в частности человека, метилирование повторяющихся участков играет важную роль в стабилизации ДНК. В свою очередь, если повторяющиеся участки деметилируются (теряют метильные метки), они становятся мутагенными и вызывают геномную нестабильность — хромосомные аномалии, каскад апоптозных реакций, онкотрансформацию клетки. Метилирование обеспечивает целостность генома, а также стабилизирует двойную спираль ДНК за счет усиления связи с комплементарным гуанином [4], [18], [19].
Процессы метилирования и деметилирования ДНК эукариот принимают участие в регуляции экспрессии генов в ходе роста, дифференцировки, старения клеток и их реакций на повреждающие воздействия [19], [20]. Негативные факторы способны переключать программы функционирования генов. В частности, метилирование задействовано в регуляции экспрессии генов в ответ на биотические (вирусные, грибковые, бактериальные инфекции) и абиотические (температура, радиация, УФ-излучение) стрессы [21–23]. К примеру, при действии радиационного стресса уровень метилирования генома снижается, вследствие чего активируется транскрипция транспозонов, избыток которых может вызывать генетическую нестабильность, хромосомные аномалии и другие повреждения ДНК. Однако в ответ на увеличение транскрипционной активности происходит обратная реакция: запускаются защитные процессы метилирования транспозонных промоторов — регуляторных участков, обеспечивающих транскрипцию (рис. 2). Таким образом, радиация провоцирует повышение уровня метилирования ДНК, что может быть проявлением защитной реакции — ответа генома на усиление транспозонной активности. То есть, с одной стороны, стресс активирует мобильные элементы и увеличивает их вредное действие, с другой — это ведет к запуску эпигенетического «молчания» транспозонов и стабилизации хромосом. Также в пользу того, что метилирование ДНК участвует в защите генома, поддерживая его постоянство в изменяющихся условиях, говорит и тот факт, что искусственное снижение метилирования вызывает увеличение транспозонной активности и количества хромосомных перестроек [13], [24].
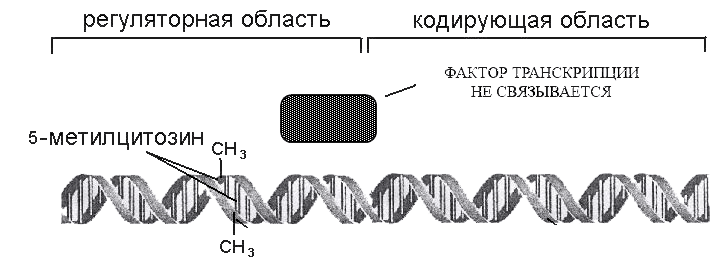
Рисунок 2. Метильные группы в регуляторной области гена препятствуют транскрипции. Механизм — прямое ингибирование.
Согласно данным, полученным на животных, радиация способствует подавлению тотального метилирования в непосредственно облученных тканях, а также в тканях-«свидетелях». До недавнего времени считалось, что биологические последствия ионизирующего облучения связаны с прямыми повреждениями ДНК. Но сегодня эта концепция дополнена. Было обнаружено, что облученные клетки провоцируют повышение уровня генных мутаций и хромосомных аберраций (нарушений структуры хромосом) в соседних клетках, которые не подвергались действию радиации. То есть молекулярные и клеточные эффекты в них обусловлены не самόй ионизирующей радиацией, а сигналом повреждения из облученных клеток. Эти реакции называются эффектом свидетеля. Они хорошо изучены на культурах клеток. Предполагается, что облученные клетки выделяют эпигенетические сигнальные факторы, которые и в необлученных соседках вызывают аналогичные изменения. Природа этих факторов и точный механизм «эффекта свидетеля» еще довольно слабо исследованы [25].
Если провести аналогию между геномом и человеческим обществом, то транспозоны можно было бы сравнить с антисоциальными элементами или просто нарушителями общественного порядка. В зависимости от размеров и мест локализации транспозоны могут быть как мелкими хулиганами, так и опасными преступниками, сеющими хромосомный беспорядок. Метилирование в таком случае считалось бы внутригеномной полицейской службой, поскольку именно оно выступает основным механизмом, предотвращающим разгул транспозонного «бандитизма» в ДНК. Навешивание метильных меток на потенциально опасные генетические последовательности изолирует их от общества, обеспечивает стабильность и порядок, позволяя добропорядочным генам спокойно трудиться на благо клетки и организма.
Старость — не радость, а эпигенетическая программа
Эпигеном — пластичная система, функционирующая в соответствии с программой развития и реагирующая на воздействие внешних факторов. Считается, что существует эпигенетически обусловленный каскад изменений, охватывающих процессы старения и реакции на стрессовые факторы [26–28]. Поэтому одним из важных направлений современных исследований является выяснение роли метилирования цитозина в регуляции экспрессии генов в механизмах стрессового ответа и возрастной деградации. Понимание аспектов эпигенетического контроля старения поможет прояснить, что служит отправной точкой этого процесса.
При старении наблюдается уменьшение числа генов, «работающих» в молодости, и активация генов, которые «спали», пока организм был полон бодрости и здоровья, но «проснулись» на этапе его одряхления. Потеря функциональной активности генов, нарушение проницаемости мембран, увеличение количества неактивного хроматина, возрастание частоты хромосомных аберраций, изменение паттернов (шаблонов) метилирования тотальной ДНК и отдельных генов — всё это составляет многокомпонентный детерминированный процесс старения. И хотя пока не найдены группы генов, запускающие каскад молекулярных событий в стареющей клетке, осуществление программы старения в последнее время часто связывают с эпигенетическими механизмами (рис. 3).
По некоторым предположениям, метилирование ДНК запрограммировано и играет ключевую роль в реализации процесса возрастной гибели клеток. Концепция запрограммированной гибели клеток в ходе старения объясняется активацией эпигенетических механизмов на фоне снижения эффективности репарационных (ремонтных) систем. Согласно одной из гипотез, апоптоз (программируемая клеточная гибель) связан с активацией определенных «генов старения», которые запускают деградационные процессы в клетке. Это происходит путем снижения уровня метилирования ДНК, что наблюдается в процессе старения дифференцированных клеток и сопровождается дерепрессией хроматина. В итоге активируются дремлющие транспозоны, склонные ввергать клетку в состояние генетического хаоса. Возрастная потеря метильных меток ускоряет клеточную гибель, в ткани меняется цитокиновый фон, что может подталкивать к гибели соседние клетки. Таким образом, старение чем-то сродни медленным инфекциям. И даже иногда к ним приравнивается: некоторые биологи допускают возможность миграции «освобожденных» транспозонов в другие клетки [1], [29–32].
Рисунок 3. Эпигенетика отсчитывает часы жизни. Подробно о «часах жизни» и их разновидностях рассказано в статьях [16], [33], [34].
Возрастное снижение метилирования было доказано на примере горбуши в середине ХХ столетия [35]. Позже это подтвердилось и в отношении других организмов. Также было установлено, что искусственное деметилирование ведет к преждевременному старению животных. Идея о том, что старение и уменьшение метилирования взаимосвязаны, стала новым словом в эпигенетике. Кроме того, снижение метилирования в ходе старения ведет к конформационным изменениям хроматина, что повышает доступность ДНК для нуклеаз (ферментов-разрушителей) и нарушает целостность макромолекул стареющей клетки. При ослаблении метилирования ДНК становится более чувствительной к действию вредных факторов, эндогенных ферментов, транспозонов [26], [36]. Стабильность генома у организмов с более «молчаливыми» транспозонами выше, что делает их устойчивыми к повреждающим факторам среды и обеспечивает им бόльшую продолжительность жизни в сравнении с организмами, чей уровень репрессии мобильных генетических элементов низок. Полагают, что восстановление в стареющей клетке эпигенетических маркеров, свойственных молодой клетке, может привести к необходимой репрессии транспозонов, стабилизации генома и замедлению темпов старения [37], [38].
С возрастом снижается экспрессия генов поддержания клеточного равновесия, в результате чего начинается свойственная старению деградация тканей и органов. Происходит увеличение числа разрывов в ДНК и сшивок ДНК с белком, снижаются активности ферментов поддержания структуры хромосом и количество 5-метилцитозина, накапливаются структурные дефекты. Процесс старения сопровождается транскрипцией определенных генов и синтезом ряда белков. Этот каскад сурово скоординированных событий подчинен некой программе. Переход к каждой новой стадии онтогенеза (индивидуального развития) характеризуется изменениями эпигенетического статуса, который обеспечивает активацию или репрессию специфического набора генов. С помощью воздействия на эпигеном можно некоторым образом корректировать генетическую программу развития живых организмов [36], [39–41].
Все перечисленные процессы действуют в направлении ухудшения состояния и функционирования генетического аппарата. А реализуются они под действием внешних и внутренних факторов. Старение — это результат изменения надгеномных процессов, которые на определенном этапе онтогенеза запускают деструктивные механизмы по двум направлениям. С одной стороны, происходит индукция генетической программы деградации структур и функций, которая репрессирует гены поддержки клеточного гомеостаза и активирует гены, отвечающие за реакции распада. С другой стороны, запускается механизм ослабления деятельности защитных систем, что делает клетку восприимчивой к повреждающему действию стрессовых факторов. Несмотря на эффективную репарационную машину, в структуре ДНК с возрастом накапливаются разрывы и другие дефекты, всё меньше и меньше индуцируются защитные белки теплового шока, в делящихся клетках сильно сокращается длина теломер (защитных концевых участков хромосом). Всё это — элементы единого многосложного процесса надгеномной регуляции процессов старения. Согласно некоторым гипотезам, множественность механизмов старения эукариот может быть обусловлена тем, что природа страхуется от появления долгоживущих видов и особей [42], [43].
Молекулярные механизмы старения сегодня интенсивно изучаются, тем не менее предложенные концепции не позволяют создать общую картину, объяснить многочисленные противоречия, закономерности индукции этого процесса и причины, обусловливающие тождественность старения у различных организмов . Однако можно сделать несколько гипотетических выводов: почти все многоклеточные организмы подвержены старению, но принцип функционального обеспечения этого процесса неизвестен; старение необратимо и затрагивает все системы, что в какой-то мере затрудняет поиск программ, отвечающих за его развитие; старение не может быть обусловлено одним специальным механизмом, иначе спонтанное нарушение его работы приводило бы к преодолению видового лимита продолжительности жизни; молекулярная природа старения основывается на взаимодействии генетических и эпигенетических путей регуляции, что делает процесс старения надежным, стабильно развивающимся и невосприимчивым к радикальной коррекции извне. Одна из задач эпигенетики — исследование того, как изменение образа жизни человека может повлиять на гены и способствовать продлению жизни индивида [1], [29], [31].
Метки смерти на генах. Метилирование и онкогенез
Недостаточное метилирование (гипометилирование) генома было одним из первых выявленных эпигенетических маркеров онкозаболеваний. Гипометилирование ведет к активации генов, которые в норме должны молчать. В случае опухолей это индивидуальные онкогены, пребывающие в здоровой клетке в метилированном (неактивном) состоянии. Понижение тотального уровня метилирования генома выражается в снятии естественных репрессивных меток с онкогенов, что вызывает каскад разрушительных событий. Попутно гипометилирование больших участков генома активирует транспозоны, за счет чего увеличивается хромосомная нестабильность и растет число аномалий. Эти два процесса ставят клетку на путь онкологической трансформации. Во многих лабораториях именно тотальное гипометилирование ДНК диагностируется как основной признак раковых клеток [15], [47], [48].
Вместе с тем, онкогенез сопровождается и гиперметилированием (избыточным метилированием) CpG-островков в области промоторов генов (рис. 4). В норме 90% CpG-островков не метилированы, то есть транскрипционно активны. Метилирование в этих участках чревато фатальными последствиями, поскольку вызывает «выключение» генов — супрессоров (подавителей) опухолей. Гены-онкосупрессоры, противостоящие онкологическому процессу, перестают работать, что дает зеленую улицу раковой трансформации, вызывает бесконтрольное деление клеток опухоли. Одним из лабораторных маркеров диагностики рака на ранних стадиях выступает повышенное метилирование CpG-островков генов — супрессоров опухолей [49], [50].
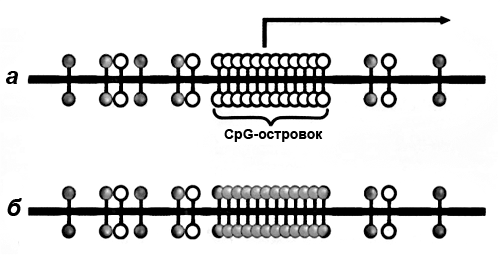
Рисунок 4. CpG-островок промоторной области гена. а — Транскрипционно активный (неметилированный) островок. б — Сайленсированный (метилированный) островок.
Как видим, рак не обходится без эпигенетических событий. Как недостаток метилирования, так и его избыток в равной мере способствуют раковому перерождению здоровой клетки. Нарушенное метилирование ведет к аномалиям развития и опухолеобразованию. Как тут не вспомнить о том, что всё хорошо в меру. Онкогенез — это многофакторный и многоэтапный процесс, включающий в себя как активацию онкогенов, так и молчание генов-онкосупрессоров. Каждое из этих нарушений эпигенома для опухолевой прогрессии имеет не меньшее значение, чем генетические нарушения, то есть служит эпигенетическим эквивалентом генетической мутации [50]. Изменение нормальных паттернов (шаблонов) метилирования ДНК неизбежно ведет к отрицательным последствиям. А сохранение здорового статуса метилирования генома является основным условием нормального развития организма.
Выходит, что рак — это не только генетически обусловленное заболевание, как считалось раньше, а заболевание, в основе которого лежит ряд еще во многом не изученных эпигенетических изменений. При этом нельзя считать, что неправильное метилирование — всего лишь маркер онкозаболевания; зачастую оно выступает причиной последнего. Так, например:
- Гиперметилирование промоторов, обусловливающее инактивацию генов-онкосупрессоров, в 70% случаев способствует развитию таких онкопатологий, как гепатокарцинома и аденокарцинома поджелудочной железы.
- Гиперметилирование CpG-островков гена рецептора эстрогена (ER) обнаруживается в опухолях толстой кишки и молочной железы.
- Ген транскрипционного фактора MyoD, специфичного для мышечной ткани, гиперметилируется при раке мочевого пузыря и толстой кишки.
- Ген кальцитонина гиперметилирован по CpG-островку, что наблюдается при лимфомах и раке легкого.
- Опухоли молочной железы вызываются инактивацией генов BRCA1, MYOD и ER посредством их метилирования.
- Аберрантное метилирование промотора гена тканевого ингибитора металлопротеиназы характерно для разных опухолей: немелкоклеточного рака легкого — в 19% случаев, рака молочной железы и толстой кишки — в 27%, карциномы почки — в 78%, глиобластомы — в 26% [51], [52].
- Гиперметилирование промоторной области играет ключевую роль в инактивации гена-онкосупрессора HIC1, что вызывает развитие опухолевых процессов в различных органах. Замечено, что обработка клеток опухоли деметилирующими агентами вызывает восстановление экспрессии этого гена, вследствие чего опухоль претерпевает обратное развитие [52], [53].
Здесь стоит отметить, что активация гена, наступающая вследствие деметилирования определенных сайтов, может происходить только в том случае, если в клетке присутствует специфический транскрипционный фактор. Этим объясняется ограниченное количество генов, активированных в опухолях посредством гипометилирования [50].
Однако нельзя забывать, что недостаток метилирования ДНК так же опасен, как и его избыток, и так же служит причиной ряда онкопатологий. К примеру, при хроническом лимфолейкозе наблюдается тотальное деметилирование ДНК в раковых клетках на фоне высокой ДНК-метилтрансферазной активности. Тотальное снятие метильных меток оказывает значительное дестабилизирующее действие на геном эукариот, меняет структуру хроматина, степень его конденсации, время репликации, что может вызывать нарушения экспрессии различных генов [15], [54].
Вместе с тем не менее опасна и спонтанная потеря сайтов метилирования. Спонтанное дезаминирование (потеря аминогрупп) 5-метилцитозина приводит к возникновению остатка тимина и образованию неканонической пары оснований Г:Т, которая становится мишенью для системы репарации. Репаративные ферменты удаляют тимин из этой пары и восстанавливают исходную последовательность Г:Ц, однако иногда возникают мутации, выражающиеся в замене пары Г:Ц на А:Т. Именно нестабильность 5-метилцитозина и спонтанные замены Г:Ц на А:Т привели в ходе эволюции к низкому уровню CpG-динуклеотидов в геноме млекопитающих. Таким образом, спонтанный мутагенез, происходящий в животной клетке при отсутствии экзогенных и эндогенных агентов, нарушает структуру многих генов, в том числе и онкосупрессоров. Этот механизм играет не последнюю роль в процессах онкологической трансформации [55].
Помимо аберрантного метилирования промоторов генов-онкосупрессоров, в опухолевых клетках обнаруживается и нестабильность микросателлитов (коротких тандемных повторов ДНК), при которой микросателлитные маркеры представлены одновременно многими разными аллелями, дополнительными к двум родительским [52], [56]. Сателлитные ДНК в геноме человека в норме высоко метилированы. В процессе опухолеобразования наблюдается микросателлитная нестабильность, резкое гипер- или гипометилирование (в зависимости от вида опухоли). В качестве примера здесь можно упомянуть ген MLH1, продукт которого участвует в репарации ошибок спаривания нуклеотидов. Гиперметилирование промотора этого гена и микросателлитная нестабильность ассоциированы с опухолями желудочно-кишечного тракта и некоторых других органов [52].Изменчивость микросателлитных последовательностей по-разному проявляется на разных стадиях развития и зависит от состояния дифференцировки и типа ткани [57].
Однако не все гены задействованы в эпигенетических событиях канцерогенеза. Ген белка р53 не содержит в своей промоторной области CpG-островков и не поддается метилированию. Нарушение функций р53 наблюдаются во многих случаях рака, но инактивация его гена обусловлена не эпигенетическими, а генетическими механизмами. В кодирующей части гена присутствуют одиночные метилированные CpG-динуклеотиды, которые в силу спонтанного дезаминирования 5-метилцитозина мутируют с заменой комплементарных пар [50], [52].
Эксперименты, в которых искусственно создавали гипер- или гипометилирование, показали интересные результаты. Исключение из рациона крыс аминокислоты метионина приводило к гипометилированию ДНК и развитию рака у подопытных животных уже спустя две недели. В то же время мыши, трансгенные по гену человеческой ДНК-метилазы, заболевали раком вследствие гиперметилирования их генома [58]. Все эти опыты по воздействию на эпигеном внушают оптимизм: появление в недалеком будущем препаратов, направленных на «лечение» эпигенома на ранних стадиях заболевания, перестает быть фантастикой. Вполне возможно, что очень скоро будет произведена «таблетка от рака», способная оказывать благотворное воздействие на эпигеном .
Кстати, подобные таблетки фармкомпании уже производят, да и природа не отстает: вещества — модификаторы эпигенома обнаружены в растительных продуктах, особо почитаемых приверженцами здорового питания: «Пилюли для эпигенома» [59]. Только вот к природным «технологиям» есть небольшая (для всех, кроме фармацевтов, Эркюля Пуаро и детектива Монка) претензия: беспорядочно там всё как-то… — Ред.
Перспективы изучения эпигенома
Общая черта, присущая как метилированию, так и мутациям — это наследуемость, хотя в отличие от большинства мутаций метилирование — процесс обратимый. Контроль модификации ДНК интересен прежде всего для биотехнологической отрасли. Воздействуя на эпигеном, можно не только вылечить ряд заболеваний, но и добиться промышленной выгоды. К примеру, направленная регуляция экспрессии генов у растений способна увеличить их продуктивность. Замечено, что в результате обработки 5-азацитидином наблюдается увеличение белка в зерновках пшеницы за счет активации генов запасных белков. Причем индуцированные химическим агентом признаки сохраняются в течение трех поколений. Какие механизмы отвечают за возвращение к исходному паттерну метилирования, соответственно, и к исходному фенотипу — пока неизвестно [60], [61].
Как отмечалось выше, эпигеном — система пластичная, что позволяет в перспективе подобраться к рычагам управления эпигенетическими модификациями, минимизировать действие неблагоприятных факторов и обеспечить оптимальные условия для существования клетки. Ключ к разгадке наследственных патологий, продлению жизни, управлению полезными свойствами живых организмов — всё это сулит эпигенетика. Уже сегодня можно без преувеличения сказать, что открытия в области эпигенетики в скором времени поднимут биологическую науку на качественно новый уровень развития, и это кардинальным образом изменит саму человеческую цивилизацию.
Список источников
- Берестяная А.Н. (2014). Метилирование как важнейший механизм эпигенетической регуляции у эукариот. Успехи современной биологии. 134, 363–376;
- Геном человека: как это было и как это будет;
- В полку генов убыло;
- Мушкамбаров Н.Н. и Кузнецов С.Л. Молекулярная биология. М.: Медицинское информационное агентство, 2007. — 535 с.;
- Mazzio E.A. and Soliman K.F. (2012). Basic concepts of epigenetics. Impact of environmental signals on gene expression. Epigenetics. 7, 119–130;
- Развитие и эпигенетика, или история о минотавре;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?;
- Эпигенетика: невидимый командир генома;
- Старение и долголетие: эпигеном раскрывает тайны;
- Pelizzola M. and Ecker J. (2011). The DNA methylome. FEBS Lett. 585, 1994–2000;
- Vanyushin B.F. and Ashapkin V.V. DNA methylation in plants. NY: Nova Biomedical Books, Nova Science Publishers, 2011. — 152 p.;
- Шестое ДНК-основание: от открытия до признания;
- Jiang H. and Kohler C. (2012). Evolution, function, and regulation of genomic imprinting in plant seed development. J. Exp. Bot. 63, 4713–4722;
- Kalisz S. and Purugganan M. (2004). Epialleles via DNA methylation: consequences for plant evolution. Trends Ecol. Evol. 19, 309–314;
- Lee T., Zhai J., Meyers B. (2010). Conservation and divergence in eukaryotic DNA methylation. Proc. Natl. Acad. Sci. USA. 107, 9027–9028;
- Часы старения: обнулить, замедлить, обратить вспять?;
- Iver L.M., Abhiman S., Aravind L. (2011). Natural history of eukaryotic DNA methylation systems. Prog. Mol. Biol. Transl. Sci. 101, 25–104;
- Merrifield M. and Kovalchuk O. (2013). Epigenetics in radiation biology: a new research frontier. Front. Genet. 4, 40;
- Seong K., Maekawa T., Ishii S. (2012). Inheritance and memory of stress-induced epigenome change: roles played by the ATF-2 family of transcription factors. Genes Cells. 17, 249–263;
- Pecinka A., Dinh H.Q., Baubec T. (2010). Epigenetic regulation of repetitive elements is attenuated by prolonged heat stress in arabidopsis. Plant Cell. 22, 3118–3129;
- Choudhuri S., Cui Y., Kiaassen C. (2010). Molecular targets of epigenetic regulation and effectors of environmental influences. Toxicol. Appl. Pharmacol. 245, 378–393;
- Msogoya T.J. and Grout B.W. (2012). Cytosine DNA methylation changes drought stress responses in tissue culture derived banana (Musa AAA — East Africa) plants. J. Appl. Biosci. 49, 3383–3387;
- Kapazoglou A. and Tsaftaris A. Epigenetic chromatin regulators as mediators of abiotic stress responses in cereals. In: Abiotic Stress in Plants — Mechanisms and adaptations / ad. by Shanker A. and Venkateswarlu B. Rijeka: InTech, 2011. — 428 p.;
- Koturbash J., Rugo R., Hendricks C., Loree J., Thibault B., Kutanzi K. et al. (2006). Irradiation induces DNA damage and modulates epigenetic effectors in distant bystander tissue in vivo. Oncogene. 25, 4267–4275;
- Литтл Д.Б. (2007). Немишенные эффекты ионизирующих излучений: выводы применительно к низкодозовым воздействиям. Радиац. биология. Радиоэкология. 47, 262–272;
- Zhu J.K. (2011). Active DNA demethylation mediated by DNA glycosylases. Annu. Rev. Genet. 43, 143–166;
- Campi M., D’Andrea L., Emiliani J., Casati P. (2012). Participation of chromatin-remodeling proteins in the repair of ultraviolet-B-damaged DNA. Plant Physiol. 158, 981–995;
- Hou K., Wu W., Gan S. (2013). SAUR36, a small auxin up RNA gene, is involved in the promotion of leaf senescence in Arabidopsis. Plant Physiol. 161, 1002–1009;
- Берестяная А.Н. и Гродзинский Д.М. (2012). Роль теломер в процессе клеточного старения. Науковий вісник Ужгородського університету. Серія Біологія. 33, 5–16;
- Берестяна А.М. и Гродзинський Д.М. (2011). Роль мутагенних факторів у процесі старіння живих організмів. Науковий вісник ужгородського університету. Серія Біологія. 30, 118–127;
- Берестяна А.М. (2013). Особливості природного та радіаційно-індукованного старіння монокарпічних рослин. Науковий вісник Ужгородського університету. 34, 11–21;
- Trindade L.S., Aigaki T., Peixoto A., Balduino A., Mânica da Cruz I.B., Heddle J.G. (2013). A novel classification system for evolutionary aging theories. Front. Genet. 4, 25;
- Молекулярные часы нашего сердца;
- Молекулярные часы работают не так, как мы думали;
- Бердышев Г.Д., Коротаев Г.К, Боярских Г.В., Ванюшин Б.Ф. (1967). Исследование нуклеотидного состава ДНК в соматических тканях нерестующей горбуши. Цитология и генетика. 1, 56–60;
- Liang R., Bates D.J. Wang E. (2009). Epigenetic control of microRNA expression and aging. Curr. Genomics. 10, 184–193;
- Mladek C.L., Popova O., Kiok K. (2010). Transgenerational inheritance and resetting of stress-induced loss of epigenetic gene silencing in Arabidopsis. Mol. Plant. 3, 594–602;
- He X.J., Chen T., Zhu J.K. (2011). Regulation and function of DNA methylation in plants and animals. Cell Res. 21, 442–465;
- Chinnusamy V. and Zhu J. (2009). Epigenetic regulation of stress responses in plants. Curr. Opin. Plant Biol. 12, 133–139;
- Vining K.J., Pomraning K.R., Wilhelm L.J., Priest H.D., Pellegrini M., Mockler T.C. et al. (2012). Dynamic DNA cytosine methylation in the Populus trichocarpa genome: tissue-level variation and relationship to gene expression. Genomics. 13, 27;
- Rando T.A. and Chang H.Y. (2012). Aging, rejuvenation, and epigenetic reprogramming: resetting the aging clock. Cell. 148, 46–57;
- Скулачёв В.П. (1997). Старение организма — особая биологическая функция, а не результат поломки сложной живой системы: биохимическое обоснование гипотезы Вейсмана. Биохимия. 62, 1394–1399;
- Blasco M.A. (2005). Telomeres and human disease: ageing, cancer and beyond. Nat. Rev. Genet. 6, 611–622;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- Нутригеномика: питание vs. заболевания;
- Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни;
- Poleshko A., Einarson M.B., Shalginskikh N., Zhang R., Adams P.D., Skalka A.M., Katz R.A. (2010). Identification of a functional network of human epigenetic silencing factors. J. Biol. Chem. 285, 422–433;
- Fouse S.D., Nagarajan R.P., Costello J.F. (2010). Genome-scale DNA methylation analysis. Epigenomics. 2, 105–117;
- Sharif J., Endo T.A., Toyoda T., Koseki H. (2010). Divergence of CpG island promoters: A consequence or cause of evolution? Dev. Growth Differ. 52, 545–554;
- Ray G. and Husain S.A. (2002). Oxidants, antioxidants and carcinogenesis. Indian J. Exp. Biol. 40, 1213–1232;
- Bhutani N., Burns D.M., Blau H.M. (2011). DNA demethylation dynamics. Cell. 146, 866–872;
- Laird P. (2005). Cancer epigenetics. Hum. Mol. Genet. 14, 65–76;
- Issa J.P., Ottaviano Y.L., Celano P., Hamilton S.R., Davidson N.E., Baylin S.B. (1994). Methylation of the oestrogen receptor CpG island links ageing and neoplasia in human colon. Nat. Genet. 7, 536–540;
- Fukushima N., Sato N., Sahin F., Su G.H., Hruban R.H., Goggins M. (2003). Aberrant methylation of suppressor of cytokine signalling-1 (SOCS-1) gene in pancreatic ductal neoplasms. Br. J. Cancer. 89, 338–343;
- Zemach A., McDaniel I.E., Silva P., Zilberman D. (2010). Genome-wide evolutionary analysis of eukaryotic DNA methylation. Science. 328, 916–119;
- Cantu D., Vanzetti L.S., Sumner A., Dubcovsky M., Matvienko M., Distelfeld A. et al. (2010). Small RNAs, DNA methylation and transposable elements in wheat. BMC Genomics. 11, 408;
- Toyota M. and Suzuki H. (2010). Epigenetic drivers of genetic alterations. Adv. Genet. 70, 309–329;
- Herman J.G. and Baylin S.B. (2003). Gene silencing in cancer in association with promoter hypermtehylation. N. Engl. J. Med. 341, 2042–2054;
- Пилюли для эпигенома;
- Ilnytskyy Y., Koturbash I., Kovalchuk O. (2009). Radiation-induced bystander effects in vivo are epigenetically regulated in a tissue-specific manner. Environ. Mol. Mutagen. 50, 105–113;
- Marfil C.F., Camadro E.L., Masuelli R.W. (2009). Phenotypic instability and epigenetic variability in a diploid potato of hybrid origin, Solanum ruiz-lealii. BMC Plant Biol. 9, 21.

