Почему так сложно похудеть, или влияние кишечной микробиоты на метаболизм
Каждый из нас хоть раз в жизни мечтал похудеть без изнурительных физических нагрузок и соблюдения строгой диеты. «Невозможно!» — скажете вы? «Нет ничего невозможного», — ответит наука. Ведь у каждой девушки есть стройная подруга, которая, не соблюдая принципы правильного питания, остается худой. «Хороший метаболизм», — мило улыбаясь, отвечает она. «Хорошая микрофлора в кишечнике», — скажу я. Эта статья расскажет вам о взаимосвязи между кишечной микрофлорой и объемом талии. Интересно? Тогда читайте дальше!

Проблема ожирения касается всего мира, что наглядно показывает карта на рисунке 1. Разумеется, мы не можем оставаться равнодушными к ней. Так давайте разберемся, в чем причина этого заболевания, и можно ли побороть ожирение?
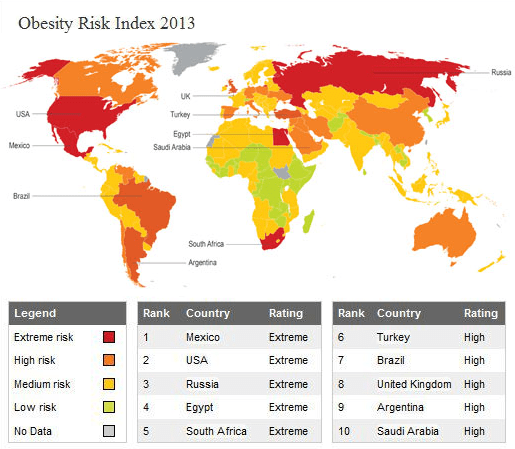
Степень риска ожирения в странах мира в 2013 г.
Не пропустите самое важное о науке и здоровье!
Подпишитесь на рассылку и получайте самые важные новости прямо на вашу почту
Микробиота кишечника — ключ к пониманию причин проблемы?
Микробиота кишечника — это микроорганизмы, которые живут в желудочно-кишечном тракте в симбиозе с человеком. Они делятся на полезных (которые помогают нашему организму, выполняя ряд жизненно важных функций), условно патогенных (которые в норме находятся в кишечнике в небольшом количестве, но при снижении иммунитета и увеличении их популяции могут приводить к ряду заболеваний) и патогенных (которые приносят вред здоровью человека). Нормофлора, или полезная микрофлора (бифидобактерии, бактероиды, лактобактерии, фузобактерии, кишечная палочка, энтерококки, стафилококки) обеспечивает ряд важных функций:
- Защитная функция выполняется за счет формирования защитного барьера слизистой оболочки кишечника. Нормофлора (облигатная микрофлора) подавляет или уменьшает прилипание патогенных агентов путем конкурентного исключения. Например, лактобактерии пристеночной (мукозной) микрофлоры занимают определенные рецепторы на поверхности эпителиальных клеток. Патогенные бактерии, которые могли привязаться к тем же рецепторам, устраняются из кишечника из-за того, что им просто некуда прикрепиться. Также облигатная микрофлора может более «агрессивно» бороться с чужаками: например, бифидобактерии за счет ферментации олиго- и полисахаридов продуцируют молочную кислоту и ацетат, которые подавляют рост патогенных бактерий, что повышает резистентность организма к кишечным инфекциям.
- Также микробиота выполняет иммуногенную функцию (за счет стимуляции иммунной системы, местного иммунитета, в том числе выработки иммуноглобулинов). Например, энтерококки могут активировать В-лимфоциты и повышать синтез IgA (который отвечает за местный иммунитет), а кишечная палочка вырабатывает колицин В, чем подавляет рост патогенной микрофлоры. Лактобактерии воздействуют на специфические скопления лимфоидной ткани, благодаря этому происходит стимуляция клеточного и гуморального иммунных ответов.
- Также эти микроорганизмы участвуют в обмене веществ, обеспечивая мембранное пищеварение, регулируя биотрансформацию желчных кислот путем уменьшения всасывания холестерина из пищеварительного тракта. А холестерин, как известно, является материалом для образования желчных кислот в печени. Вместе с тем они формируют иммунологическую толерантность к пищевым и микробным агентам. Нормальная микрофлора участвует в синтезе и всасывании витаминов группы В, фолиевой и никотиновой кислот, кальция, железа и витаминов D и K. Кроме того, благодаря ферментам микроорганизмов переваривается клетчатка (например, целлюлоза), которая без их помощи не усваивается. После анаэробного расщепления клетчатки образуется водород, двуокись углерода, метан и летучие жирные кислоты (большая часть которых всасывается в кровь и используется для энергетических целей). Исходя из этого, появляется еще одна важная функция — выработка и снабжение организма энергией или энергетическим субстратом (бутиратом).
Анализируя эти данные, мы понимаем, насколько важный вклад в наше здоровье вносит кишечная микробиота. Как говорил Георгий Ратнер: «Только подумать, какие умнейшие и сложнейшие процессы непрерывно ведет организм, чтобы сохранить нам здоровье, и как глупо и бездарно в жизни действуем мы сами».
От чего зависит состав кишечной микробиоты (КМ)?
Количественный и качественный состав зависит от многих факторов:
- возраст (у людей пожилого возраста снижается процент лактобактерий и бифидобактерий);
- общее состояние организма (наличие хронических заболеваний ЖКТ);
- прием лекарственных препаратов (антибиотиков);
- генетические особенности организма;
- питание.
Например, у приверженцев западной диеты (с высоким содержанием жиров) наблюдается уменьшение популяции Bacteroidetes и увеличение Firmicutes в составе кишечной микробиоты (КМ) [1]. Разумеется, тот факт, что регулярный прием жирной пищи приводит к ожирению, не является новым, но какую роль тут играет кишечная микрофлора? И что будет, если перенести часть кишечной микробиоты от мыши, страдающей ожирением, в организм стерильной (лишенной микрофлоры кишечника)? И могут ли определенные группы микроорганизмов приводить к ожирению? Давайте попробуем найти ответы на все эти вопросы.
Есть ли связь между ожирением и составом КМ?
Ванесса Ридаура и ее коллеги поставили очень интересный эксперимент [2], [3]. Они получили образцы микрофлоры кишечника у четырех пар человеческих близнецов (в которых один из каждой пары был худым, а другой страдал ожирением). Эти образцы вводили выращенным в стерильных условиях мышам (в кишечнике этих грызунов не было микроорганизмов) и наблюдали за тем, как животные набирают массу (рис. 2). Кормили мышек кормом, богатым клетчаткой и с нормальным процентом жира.
Оказалось, что те мыши, которые получили микрофлору худых людей, спустя несколько недель сохраняли нормальный процент жира в теле, а те, которым досталась кишечная микрофлора толстяков, начинали набирать вес (хоть и питались нежирной пищей). Когда мышей обеих групп после заражения помещали в одну клетку, и они начинали обмениваться микрофлорой (мыши иногда поедают фекалии), то микробиота худых «побеждала» микробиоту толстяков: обе группы мышей оставались худыми.

Похожий эксперимент проводили исследователи из Медицинской школы Мичиганского университета [4]. Поначалу биологи вырастили поколение стерильных мышек (без кишечной микрофлоры). После этого заселили их кишечник человеческими бактериями (материал взяли из фекалий здорового человека с нормальной массой тела). Далее лабораторных грызунов разделили на две группы. Первую кормили едой с большим содержанием клетчатки, вторую — жирной и калорийной пищей, которая практически лишена клетчатки. Изначально в обеих группах показатели кала почти не отличались, но позднее были обнаружены существенные изменения. У мышей, которые употребляли мало клетчатки, обнаруживались типичные для ожирения изменениям КМ: снижение содержания в просвете толстой кишки Bacteroidetesи увеличение численности Firmicutes. Примечательно, что животные с подобными изменениями КМ были способны усваивать больше жиров из кишечника. Увеличение численности бактерий типа Firmicutes в кишечнике мышей при кормлении жиром находили на протяжении нескольких месяцев. Вернуть потерянную микрофлору помог только метод трансплантации фекалий. В этом случае по прошествии десяти дней после процедуры состав и разнообразие бактерий кишечника грызунов из разных групп уже нельзя было отличить. По мнению ученых, снижение разнообразия КМ является одной из причин ожирения, и прием жирной пищи бедной клетчаткой способствует этому [1], [5].
Подобное влияние на КМ пищи с высоким содержанием жиров найдено также у человека. Увеличение потребления калорий с 2400 до 3400 ккал/сут., как у людей с ожирением, так и без него, приводили к быстрым изменениям КМ: в фекалиях наблюдалось 20-процентное увеличение количества Firmicutes и соответствующее уменьшение Bacteroidetes [6].
Исходя из результатов этих экспериментов мы можем предположить, что в организме все же есть популяция бактерий, отвечающая за ожирение, и популяция, отвечающая за снижение массы тела. И прием жирной с пониженным содержанием клетчатки пищи способствует изменениям КМ в сторону увеличения популяции бактерий, способствующих избыточному весу [7].
Как же может кишечная микробиота вызывать ожирение?
Разумеется, мы не можем сказать, что дисбиоз является единственной причиной ожирения, так как это полиэтиологический процесс. Тем не менее он вместе с другими предрасполагающими генетическими, экологическими и социальными факторами может привести к метаболическим нарушениям в организме. Ожирение возникает тогда, когда поступление и образование энергии превышает ее потребность, а остаток неиспользованных ресурсов депонируется в жировой ткани.
Что же является одним из основных источников энергии в организме? Разумеется, это глюкоза. Результаты эксперимента [8] выявили, что у мышей с повышенным уровнем глюкозы в крови (страдающих сахарным диабетом) состав кишечной микрофлоры аналогичен составу КМ мышей с ожирением. Значит, эти процессы тесно связаны между собой [9].
Разумеется, не все люди, имеющие лишний вес, болеют сахарным диабетом, но 80% людей с сахарным диабетом имеют ожирение и чаще по абдоминальному типу, при котором жировые отложения, в основном, формируются в области живота. В народе этот тип фигуры называют «яблоком».
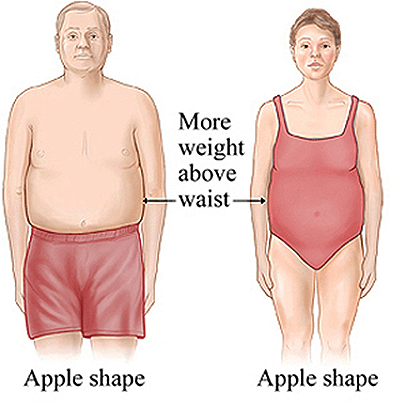
Давайте попробуем разобрать механизм, при котором глюкоза способствует ожирению. Глюкоза, попадая в кровь, повышает выработку инсулина (гормона-регулятора уровня глюкозы в крови). Инсулин в свою очередь стимулирует синтез жиров и их отложение (за счет увеличения активности ферментов липогенеза, и в первую очередь АТФ-зависимого цитратрасщепляющего фермента) и тормозит их распад [5]. При этом если человек ведет «сидячий» образ жизни, синтезированные липиды откладываются в адипоцитах (так как энергия, поступающая извне, не используется и вынуждена откладываться в виде жировой ткани про запас).
Но эти процессы происходят постоянно и в здоровом организме. Значит, для того чтобы липогенез вышел за пределы нормы, нужно либо много глюкозы, либо мало инсулина, либо нарушение взаимодействия инсулина и глюкозы. Так как мышей из эксперимента, описанного выше, кормили кормами с высоким процентом жиров, а не углеводов, значит дело не в чрезмерном поступлении глюкозы в организм. Инсулин вырабатывается β-клетками поджелудочной железы, а у мышей из предыдущих экспериментов функция железы нарушена не была. Это свидетельствало о том, что проблема не в дефиците инсулина. Хотя в 2015 году ученые выдвинули теорию о прямой связи бифидобактерий (рис. 4) с синтезом глюкагоноподобного пептида-1 [8], [10]. Глюкагоноподобный пептид-1 — это инкретин, то есть вырабатывается в кишечнике в ответ на пероральный прием пищи. Он оказывает влияние на различные органы и системы, в том числе усиливает секрецию инсулина. Пептид вырабатывается L-клетками, которые располагаются в слизистой оболочке подвздошной и толстой кишок, а бифидобактерии могут стимулировать его синтез. Соответственно, если в кишечнике уменьшается количество бифидобактерий, то уменьшается количество этого пептида, а следовательно, и уровень инсулина. Но эта теория еще требует детального изучения, поэтому назвать ее основной причиной повышения сахара в организме мы пока не можем. Значит, остается вариант с нарушением усвоения глюкозы.
Кишечная микробиота и сахарный диабет 2 типа
Сахарный диабет 2-го типа (СД II или инсулинонезависимый диабет) — это метаболическое заболевание, которое проявляется нарушением обмена углеводов. В результате патологических изменений — приобретения инсулинорезистентности, то есть невосприимчивости клеток организма к этому гормону, — развивается гипергликемия(увеличение концентрации глюкозы в крови). Простыми словами, в организме — нормальный уровень инсулина и повышенный уровень глюкозы, которая по каким-то причинам не может попасть в клетки. Давайте рассмотрим механизм образования инсулинорезистентности.
Мы видим на рисунке 5 рецептор инсулина, который состоит из двух субъединиц:
- α — реагирует с инсулином вне клетки;
- β — субъединица, которая уже связана со вторичными мессенджерами, субстратами инсулинового рецептора 1-го и 2-го типов.
Рецептор инсулина представляет собой тирозинкиназу [12]. Посредством аутофосфорилирования активируются различные пути, в частности, путь PI3K(фосфоинозитид-3-киназы), за счет которого и происходит транспорт глюкозы внутрь клетки, так как приходит в свое активное рабочее состояние транспортер глюкозы GLUT4. Так глюкоза попадает в клетку в норме.
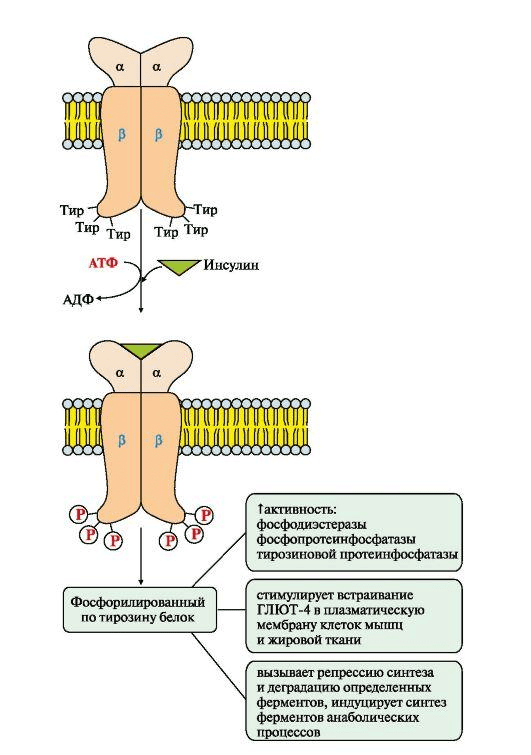
Схема активации рецептора инсулина
Рассмотрим, что происходит с этим механизмом при дисбиозе [7]. В организме увеличивается количество вредных бактерий, которые при взаимодействии с рецепторами на стенках кишечника могут вызывать процесс воспаления и активировать иммунную систему. Вы никогда не задумывались, почему наш организм не отвергает полезных микроорганизмов и как он различает, какие из них полезные, а какие вредные? А все потому, что в кишечной стенке присутствуют энтероциты, бокаловидные, дендритные и эндокринные клетки, которые помимо выполнения своей основной функции содержат толл-подобные рецепторы (англ. toll-like receptor, TLR; от нем. toll — замечательный) [13]. Эти рецепторы как раз и участвуют в распознавании «своих» и «чужих» микроорганизмов. Толл-подобные рецепторы реагируют на патоген-ассоциированные молекулярные структуры. Несмотря на то, что этих рецепторов 10 разновидностей, каждый из них распознает только свою «маркерную» часть микроорганизма. Например, TLR4 распознает бактериальный липополисахарид (ЛПС), TLR2 — бактериальный пептидогликан и липопептид, TLR3 — двухцепочечные молекулы РНК, TLR8 способен определить одноцепочечные молекулы РНК, TLR9 — бактериальные ДНК. Благодаря этим рецепторам наш организм не отвечает воспалительной реакцией на присутствие в кишечнике нормофлоры. Если же в нем нарушается соотношение полезной и транзиторной микрофлоры, толл-подобные рецепторы возбуждаются и передают сигнал тревоги внутрь клетки, что приводит к включению продукции целого ряда провоспалительных цитокинов, хемокинов и ко-стимуляционных молекул (которые индуцируют возбуждение Т-лимфоцитов). В итоге развивается воспаление как защитная реакция организма со стороны неспецифического иммунитета, и делаются первые шаги по развитию специфического (адаптивного) иммунитета.
При чем же тут инсулинорезистентность, спросите вы? Все довольно просто: эти толл-подобные рецепторы при контакте с патогенным организмом стимулируют иммунный ответ в надежде расправиться с чужаком. В ходе каскадных реакций стимулируется система макрофагов. Активированные M1-макрофаги (их еще называют классически активированными макрофагами, они отвечают за уничтожение чужеродных агентов) производят большое количество провоспалительных цитокинов: TNF-α (фактор некроза опухоли-альфа), IL-1 (интерлейкин-1) и IL-6, которые влияют на субстраты инсулинового рецептора и тем самым блокируют путь PI3K [14]. В результате путь не оказывает влияние на обмен глюкозы, и глюкоза не может войти в клетку. Таким способом развивается инсулинорезистентность, т.к. инсулиновые рецепторы становятся нечувствительны к инсулину, и его биологическая роль извращается. В условиях инсулиновой резистентности печень начинает активно синтезировать жирные кислоты, триглицериды, ускоряется липолиз, но уже в жировой ткани.
Вот мы и разобрали механизм инсулинорезистентности и его влияние на ожирение. Ученые подтвердили роль микробиоты на инсулинорезистентность экспериментально [15] путем пересадки микрофлоры от здорового донора к пациенту с сахарным диабетом 2 типа. В результате эксперимента у пациентов увеличилась чувствительность к инсулину на несколько недель. Также есть интересная теория о взаимосвязи дефицита TLR5 и ожирения [16], но это уже совсем другая история.
Вывод
К решению проблемы ожирения необходимо подходить комплексно. Физически активный образ жизни, рациональное питание, предусматривающее избегание переедания, ограничение калорийности, уменьшение количества насыщенных жирных кислот (животных жиров), относительное увеличение ненасыщенных жирных кислот (растительных жиров) и продуктов с повышенным содержанием балластных веществ остаются основными мероприятиями в профилактике и лечении ожирения. При этом если удастся подтвердить вклад конкретных микроорганизмов в снижение веса, то, возможно, будут созданы эффективные препараты-пробиотики, которые станут включать в комплексные программы лечения ожирения.
Анастасия Николаева
Источник: Биомолекула
Опубликовано
Июль, 2024
Продолжительность чтения
Около 5-6 минут
Категория
Микробиом
Поделиться

